
Jak uczyć równań reakcji chemicznych?
Równania reakcji chemicznych nie są czymś, do czego dzieci podchodzą z radością. Trudno je zrozumieć, bo też niełatwo jest wyobrazić sobie, jak to wszystko się łączy.
Nie widzimy przecież, ile wiązań może stworzyć atom sodu czy reszta kwasu azotowego. Ułatwić to może rozrysowanie całych cząsteczek, ale tu też trudno pokazać wartościowość pojedynczych atomów czy jonów.
Na potrzeby nauki o kwasach, zasadach i ich łączeniu się w sole, przygotowałam więc dla swoich uczniów klocki chemiczne, które mają odpowiednią ilość ząbków, reprezentującą "wolne łapki" do stworzenia wiązania. Na zdjęciu poniżej widać kilka takich klocków.
Klocki chemiczne



Klocki chemiczne składają się z kilku typów:
- kationy metali (niebieskie),
- grupy OH- (niebieskie),
- kationy wodoru (czerwone),
- aniony reszt kwasowych kwasów tlenowych i beztlenowych (czerwone),
- znaków plusa i strzałki do tworzenia reakcji (kremowe).
Jak można zauważyć, elementy tworzące kwasy mają kolor czerwony, a zasady i wodorotlenki - niebieski. Dzięki temu przy tworzeniu wzorów soli, widać, która część pochodzi od jakiego związku.
Sole
Z klocków można tworzyć cząsteczki kwasów, zasad, soli, a także wody. Dzięki specjalnym ząbkom (wgłębieniom w kationach i wypustkom w anionach) możemy zobaczyć, ile anionów i kationów potrzeba do utworzenia się cząsteczki - według zasady, że żadne miejsca nie może zostać puste (niepołączone z innym klockiem).



Rozszerzając temat, można tworzyć z uczniami także hydroksysole i wodorosole. Wtedy zamiast części reszt kwasowych i metali dodajemy grupy hydroksylowe (OH-) lub kationy wodoru (H+).
Równania reakcji chemicznych
Kolejną możliwością klocków jest układanie całych reakcji typu:
kwas + wodorotlenek -> sól + woda
W takim przypadku działamy według schematu:
- Układamy dwie cząsteczki kwasu.
- Układamy dwie cząsteczki wodorotlenku.
- Między jedną cząsteczką kwasu i wodorotlenku stawiamy znak +.
- Za nimi stawiamy znak zajścia reakcji →.
- Z pozostałych cząsteczek kwasu i wodorotlenku próbujemy ułożyć sól.
- Jeżeli brakuje któregoś elementu, wybieramy z zapasu klocków całą cząsteczkę z brakującym elementem (np. brakuje jednego anionu chloru Cl-: dobieramy jon H+ i Cl-, czyli całą cząsteczkę kwasu solnego).
- Z pozostałych jonów wodorowych i wodorotlenowych budujemy cząsteczki wody.
- Sprawdzamy, czy po prawej i lewej stronie reakcji mamy tyle samo klocków każdego rodzaju.
- Jeżeli tak, mamy gotowe równanie reakcji i możemy zapisać je odpowiednimi wzorami.
- Jeżeli nie, dobudowujemy odpowiednią ilość cząsteczek kwasu i wodorotlenku. Ilości cząsteczek jednego rodzaju są odpowiednikiem dużych współczynników (liczb) w równaniu reakcji.

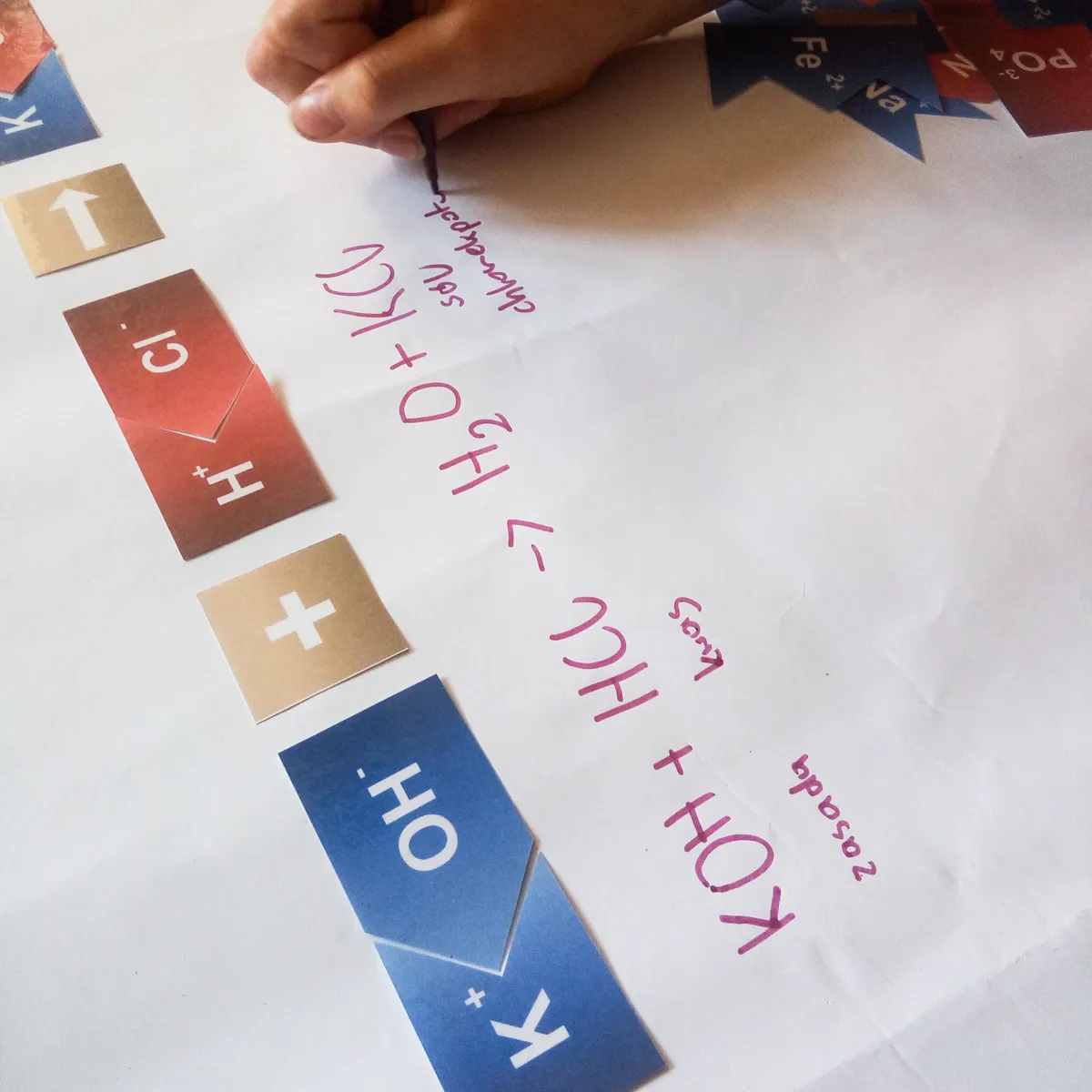

Dowiedz się więcej
Jeżeli zainteresował Cię temat klocków chemicznych i innych pomocy do nauki chemii, skontaktuj się z autorką lub sprawdź inne wpisy na stronie.
